
東京大学 特任助教
生産技術研究所 マイクロメカトロニクス国際研究センター
hiropain@iis.u-tokyo.ac.jp
| TED Plaza |
| 微細加工と細胞工学 |
 |
木村 啓志 東京大学 特任助教 生産技術研究所 マイクロメカトロニクス国際研究センター hiropain@iis.u-tokyo.ac.jp
|
|
1. はじめに
ヒト由来細胞を用いる培養実験系は,創薬の初期段階における毒性試験の動物実験代替法として盛んに行われている。しかし,既存の系では単一の臓器細胞へ対する毒性を調べることはできても,吸収・代謝といった臓器間の相互作用を考慮した体内毒性を調べることが困難であった。そこで本研究では,臓器間相互作用を考慮した体内毒性試験のためのプラットフォームとしてオンチップin vitroモデルデバイスの開発を行っている。 2. オンチップin vitroモデルの検討 微細加工技術を応用して製作したPDMS製オンチップin vitroモデルデバイスの模式図と写真を図1に示す。デバイスは多孔質膜によって上下に別けられている2つの培養コンパートメントによって構成されており,それぞれのコンパートメントには培養液を灌流するためのスターラ型マイクロポンプが内蔵されている。培養液交換用のポートを使用することで細胞の播種や培養液の交換は行われるが,培養および実験中にはポートは閉じられ,灌流は各コンパートメント内部の培養液のみで行われる。本実験では,生体内で吸収・代謝を司る小腸と肝臓のモデル細胞を共培養し,小腸膜の物質透過率の違いによる肝細胞への毒性影響変化を観察することで,経口投与を想定した体内毒性モデルとしての機能検討を行った。まず,上側コンパートメント(頂端膜側,AP)の多孔質膜上に小腸モデル細胞であるCaco-2細胞を,下側コンパートメント(基底膜側,BL)のPDMS上に肝モデル細胞であるHep G2細胞をそれぞれ培養する。このように共培養を行うことで,上側コンパートメントは生体内における小腸内腔側となり,下側コンパートメントは門脈および肝臓側となるin vitro吸収代謝モデルを構築することができる。小腸膜による透過率が異なる毒性モデル物質として,カフェイン(10 mM)とパラコート(0.25 mM)をそれぞれ小腸内腔側である上側コンパートメントのみに暴露し,24時間後の下側コンパートメントのHep G2細胞の生存率を蛍光測定により算出する。本実験では共培養(Coculture)と下側コンパートメントにHep G2細胞のみが培養されている単培養(Monoculture)での生存率の比較を行った。
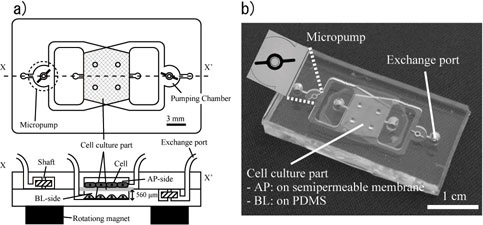 図1 オンチップin vitroモデルデバイス 各毒性モデル物質暴露後の生存率測定結果を図2に示す。カフェイン暴露によるHep G2細胞の生存率はCaco-2細胞の有無によらずほぼ同じであった。一方,パラコート暴露時には単培養に比べ共培養の方が約3倍高い生存率を示した。これらの毒性影響の違いは小腸膜の物質吸収率の違いを反映したものである。以上の結果から,本デバイスを用いて人体内で起こりうる毒性影響のin vitroモデルの構築が実現可能であることが示唆されており,動物実験代替法として広く医学や生命科学の分野へ応用することができると考えられる。
 図2 毒性モデル物質暴露後24時間における肝モデル細胞の生存率 |