俁亅俀丏掅壏惗暔岺妛偺楌巎
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂搶嫗擾岺戝妛岺妛晹
丂丂 丂丂丂丂丂 丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂 扞郪丂堦榊
侾丏偼偠傔偵
丂昅幰偼丆掅壏惗暔岺妛偺楌巎偵憿寃偑怺偄傢偗偱傕側偔丆傑偨摿偵楌巎揑側偙偲偵
嫽枴傪帩偭偰挷傋偨宱尡偑偁傞傢偗偱傕側偄偺偱丆幏昅幰偲偟偰偼傑偭偨偔晄揔擟偩
偲帺妎偡傞幰偱偼偁傞偑丆偲傝偁偊偢杮峞偺偛埶棅傪庴偗偰偐傜揇撽幃偵曌嫮偟偨偙
偲傪彂偒婰偡偙偲偱偍嫋偟偄偨偩偔偙偲偵偟偨偄丏
丂偲偙傠偱掅壏惗暔岺妛偺斖醗偵偼丆掅壏偵偍偗傞惗柦尰徾偵偐偐傢傞偁傜備傞岺妛
暘栰偑娷傑傟傞偱偁傠偆丏偟偐偟丆偦偺拞偱昅幰偑偙傟傑偱偵嫽枴傪書偒丆懡彮尋媶
傜偟偒偙偲傕傗偭偰偒偨偺偼丆惗懱偺搥寢曐懚乮cryo-preservation乯偺傒偱偁傞丏
偟偨偑偭偰埲壓偺婰弎偵偍偄偰傕丆搥寢曐懚偵偮偄偰偺榖戣傪拞怱偲偟偨偄偲偙傠偱
偼偁傞偑丆偦傟偩偗偱偼昞戣傪婾傞偙偲偵側傞偺偱丆庒姳斖埻傪奼偘丆壏搙偺應掕傗
掅壏庤弍側偳偵傕怗傟傞偙偲偵偟偨丏
俀丏壏搙偺應掕偲壏搙栚惙
丂昅幰偑彫妛惗偺崰丆晝偐傜乽掅壏偲偼懱壏傛傝傕掅偄壏搙偺偙偲傪尵偆乿偲嫵偊傜
傟丆惉傞掱偲擺摼偟偨婰壇偑偁傞丏乽壏搙乿偲偄偆忬懺曄悢偼丆尰嵼擬椡妛偵傛偭偰
尩枾偵掕媊偝傟丆偦傟偵婎偯偄偨壏搙栚惙偑掕傔傜傟偰偄傞偑丆尦乆偼僸僩偺旂晢姶
妎乮偡側傢偪旂晢昞柺壓偵偁傞壏妎丒椻妎偺庴梕婍偺壏搙巋寖偵懳偡傞斀墳乯偍傛傃
拞悤姶妎乮戝擼帇彴壓晹偵偁傞壏丒椻僯儏乕儘儞偺斀墳乯偵桼棃偡傞傕偺偱偁傠偆丏
偩偐傜丆壏偐偄丒椻偨偄丆弸偄丒姦偄偲偄偆惗棟揑敾抐偼丆僸僩偺懱壏傪婎弨偲偡傞
偙偲偵側傞丏
丂偦傟偲摨帪偵丆僸僩偺恎懱偺拞偱婲偭偰偄傞彅乆偺暔棟壔妛揑尰徾偼丆岻柇偵嶌傜
傟偨懱壏挷愡婡峔偵傛偭偰傎傏堦掕偵曐偨傟偰偄傞惓忢懱壏偺壓偱巪偔恑峴偡傞傛偆
偵側偭偰偄傞偐傜丆媡偵懱壏偑惓忢抣偐傜偢傟傞偙偲偼丆恎懱撪偵壗傜偐偺堎曄偑惗
偠偨偙偲傪堄枴偡傞丏偛偔偍偍偞偭傁偵偼妟偵庤傪摉偰偰丆傛傝惓妋偵偼懱壏寁傪梡
偄偰丆懱壏傪挷傋傛偆偲偡傞偺偼丆僸僩偲偄偆惗懱偺忬懺偺儅僋儘側恌抐朄偲偟偰摉
傪摼偨傕偺偲尵偊傞丏
丂懱壏偑僸僩偺寬峃忬懺偺堦偮偺僀儞僨傿働乕僞偱偁傞偙偲偼丆屆偔偐傜抦傜傟偰偍
傝丆堛妛偺奐慶偲尵傢傟偰偄傞Hippocrates (460?乣377 B.C.)偺挊弎偺拞偵傕偦偺
偙偲偑弎傋傜傟偰偄傞傛偆偱偁傞丏偟偐偟丆Hippocrates偺帪戙偵偼懱壏寁偼傑偩柍
偔丆懱壏偼摉慠怗恌偵傛偭偰悇應偝傟偰偄偨偱偁傠偆丏
丂傑偨乽壏搙乿偼丆婥岓偺曄摦傗怘傋暔偺挷棟丒壛岺側偳偵娭偟偰傕丆戝愄偐傜恖娫
惗妶偵枾愙側偮側偑傝傪帩偮傕偺偱偁偭偨丏婥懱傪抔傔傞偲懱愊偑憹壛偡傞偙偲丆偁
傞偄
偼懱愊偺憹壛傪梷偊傞偵偼戝偒側椡偑昁梫側偙偲偼傛偔抦傜傟偰偄偨丏婭尦侾悽婭崰
偺傾儗僉僒儞僪儕傾偵廧傫偱偄偨僊儕僔儍偺悢妛幰Heron偺敪柧偵傛傞堦庬偺忲婥摦
椡幃斷奐暵憰抲偼丆拞偱傕摿偵桳柤偱偁傞丏偟偐偟丆偙偺傛偆側壏搙偺曄壔偵敽偆暔
幙偺忬懺曄壔傪丆壏搙應掕偵寢傃偮偗偨偺偼Galileo Galilei (1564乣1642)偑嵟弶
偲偝傟偰偄傞丏
丂恾侾乮Benzinger[1]傛傝乯偼丄Galilei偺壏搙昞帵婍 (thermoscope)偺僗働僢僠偱
偁傞丏寋棏傎偳偺戝偒偝偺媴忬晹偵挿偄嵶娗偺偮側偑偭偨僈儔僗梕婍偑丆媴忬晹傪忋
偵偟偰悈偺擖偭偨暿偺梕婍偵悅捈偵棫偰傜傟偰偄傞丏僈儔僗梕婍偺媴忬晹偐傜嵶娗偺
忋晹偵偐偗偰偼嬻婥偑丆嵶娗偺壓曽晹偵偼悈偑擖偭偰偍傝丆嵶娗撪偺悈偲壓偺梕婍偺
悈偲偼楢寢偟偰偄傞丏摉慠偺偙偲側偑傜丆媴忬晹偺撪埑偼丆嵶娗晹偺悈拰崅偝偵憡摉
偡傞暘偩偗戝婥埑傛傝掅偔側偭偰偄傞丏偄傑僈儔僗梕婍偺媴忬晹傪庤偱埇傞偲丆撪晹
偺嬻婥偼抔傔傜傟偰朿挘偟丆嵶娗撪偺悈拰傪墴偟壓偘傞丏庤傪棧偣偽悈拰偼尦偺崅偝
傑偱忋徃偡傞丏偙偆偟偰丆嵶娗撪偺悈拰偺崅偝偼媴忬晹偺嬻婥偺壏搙傪帵偡偙偲偵側
傞丏偙傟偼崱偱尵偆婥懱壏搙寁偱偁傞丏悈拰崅偝偲壏搙偺娭學傪柧妋偵偟偰乮戝婥埑
偺曗惓傕壛偊偰乯丆栚惙傪梡堄偡傟偽丆尰戙偱傕棫攈偵壏搙寁偲偟偰捠梡偡傞婍嬶偲
尵偊傛偆丏
丂丂丂丂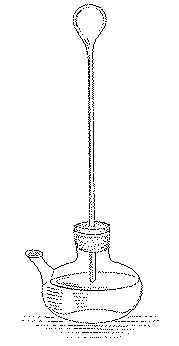
丂丂丂丂恾1丂Galilei偺壏搙寁
丂偲偙傠偱丆偡傋偰偺媞娤揑壏搙應掕偵偁偭偰偼丆壏搙偵廬偭偰堦媊揑偵曄壔偡傞暔
棟壔妛揑夁掱乮壏搙僙儞僒乕乯偲丆偦偺曄壔偑壗搙偺壏搙栚惙偵憡摉偡傞偐傪寛傔傞
偨傔偺偄偔偮偐偺壏搙掕揰偑昁梫偱偁傞丏尰嵼帺慠壢妛偺暘栰偱峀偔巊傢傟偰偄傞壏
搙栚惙偼丆悈偺嶰廳揰傪0.01亷 (273.16 K)偲掕傔傞偙偲偐傜弌敪偟丆偦偺崅壏懁丒
掅壏懁偵偦傟偧傟悢懡偔偺掕媊掕揰傪愝偗偰栚惙傪崗傫偱偄傞丏偦偟偰丆偦偺栚惙偺
崗傒偼丆崱偐傜栺250擭慜偵僗僂僃乕僨儞偺揤懱暔棟妛幰Anders Celsius (1701乣
1744)偵傛偭偰嶌傜傟丆偦偺屻儕儓儞偺Christin偑夵椙偟偨栚惙丆偡側傢偪戝婥埑壓
偱偺悈偺搥寢壏搙傪侽搙丆暒揰傪100搙偲掕傔丆偙偺娫傪 100摍暘偡傞丆偄傢備傞昐
暘栚惙(centigrade)乮偁傞偄偼愛巵搙乯傪傎傏偦偺傑傑摜廝偟偰偄傞偙偲偼峀偔抦傜
傟偰偄傞偱偁傠偆丏
丂偟偐偟丆壏搙栚惙偺憂巒幰偲偟偰偼丄Celsius傛傝傕彮偟屆偄擇恖偺壢妛幰偺柤慜傪
嫇偘傞昁梫偑偁傞丏堦恖偼塸崙偺Sir Isaac Newton (1643乣1727)丆傕偆堦恖偼僌
僟僯僗僋乮尰億乕儔儞僪乯惗傑傟偺僪僀僣偺暔棟妛幰Gabriel Fahrenheit (1686乣
1736)偱偁傞丏
丂昞侾偼丆昅幰偑偐偮偰儘儞僪儞偺壢妛攷暔娰傪朘傟偨愜偵丆壏搙寁偺楌巎偵娭偡傞
揥帵偺拞偱尒偐偗偨壏搙栚惙偵偮偄偰偺帒椏傪彂偒捈偟偨傕偺偱偁傞丏昞侾偺拞偱丆
Newton偵傛傞壏搙栚惙偼丆尰嵼傢傟傢傟偑梡偄偰偄傞栚惙偲偼偐側傝堘偭偨傕偺偵尒
偊傞偑丆Fahrenheit偵傛傞栚惙乮壺巵乯偼丆崱偱傕塸崙丒暷崙側偳偱偼擔忢惗妶偺拞
偱傆偮偆偵巊傢傟偰偄傞丏偙偺壺巵栚惙偵偮偄偰摿昅偡傋偒偙偲偼丆壏搙掕揰傪寛傔
傞偵摉偨偭偰Fahrenheit偑拝栚偟偨帠徾偺拞偵丆擇偮偺惗懱娭楢偺傕偺偑娷傑傟偰偄
傞偲偄偆偙偲偱偁傞丏偦偺堦偮偼僸僩偺懱壏丆傕偆堦偮偼寣塼偺搥寢壏搙乮偄偢傟傕
昞侾偲偼暿偺暥專偵傛傞乯偱偁傝丆慜幰偼100 哣丆屻幰偼 0哣 偵懳墳偡傞傕偺偲偝傟
偰偄傞丏100 哣偼 37.8 亷丆0 哣偼 -17.8 亷偵憡摉偡傞偐傜丆偄偢傟偺抣偵傕懡彮偺
栤戣偑偁傞偲尵偊傞偑丆偦傟埲忋偵丆惗棟揑側忬懺偵娭楢偡傞擬揑帠徾傪壏搙掕揰偵
慖傫偩偲偙傠偑嫽枴怺偄丏
昞侾丏丂奺庬偺壏搙栚惙
| 丂 | Newton | DeLisle | Fahrenheit | Reaumur |
| 悈偑搥傝巒傔傞壏搙 | 0 | 160 | 32 | 0 |
| 搤 | 1 | 154.5 | 37 | 2.3 |
| 弔偲廐 | 3 | 146 | 48 | 7.5 |
| 壞帄偺婥壏 | 6 | 132 | 63.5 | 14.5 |
| 恖懱昞柺偺嵟傕崅壏偺晹暘 | 12 | 104 | 95 | 29.5 |
| 庤傪偮偗偰偪傚偆偳懴偊傜傟傞偍搾偺壏搙 | 14.5 | 92.5 | 108 | 35.5 |
| 庤傪擖傟偰摦偐偟偨偲偒懴偊傜傟側偔側傞偍搾偺壏搙 | 17 | 81 | 121 | 41.5 |
| 梈偗偨傠偆偑屌傑傝晄摟柧偵側傞壏搙 | 20 | 67.5 | 136 | 48.5 |
| 庰惛偑偪傚偆偳暒摣偟巒傔傞壏搙 | 25 | 43.5 | 163 | 61 |
| 悈偑暒摣偟巒傔傞壏搙 | 33 | 7 | 204 | 80.5 |
| 悈偑寖偟偔暒摣偡傞壏搙 | 34.5 | 0 | 212 | 84 |
丂惗棟妛偺拞偵壏擬惗棟妛偲屇偽傟傞暘栰偑偁傝丆偦偙偱偼恖懱傊偺奜晹偐傜偺擬揑
巋寖偵懳偡傞僸僩偺惗棟揑斀墳偑庡側尋媶偺懳徾偲偝傟偰偄傞丏慜弎偺傛偆偵丆僸僩
偺懱壏帺懱偼捠忢偛偔彫偝側壏搙暆偱偟偐曄摦偟側偄偐傜丆應掕偵巊傢傟傞壏搙寁傕
乮椺偊偽懱壏寁偺傛偆偵乯悢搙偺壏搙堟偑昞帵偱偒傟偽廫暘偱偁偭偨丏偟偐偟丆師偵
弎傋傞惗懱偺搥寢曐懚偵偍偄偰偼丆戝婥埑壓偱偺拏慺偺塼壔壏搙偱偁傞 -196亷傑偱
偺峀偄壏搙斖埻偑栤戣偲側傞丏偦偟偰丆偙偺峀偄斖埻偺掅壏搙堟偵偍偗傞惗懱尰徾偵
偮偄偰偼傑偩傑偩枹抦偺帠暱偑懡偄丏
俁丏掅懱壏庤弍偲搥寢曐懚
丂僸僩偵尷傜偢丆偁傜備傞惗暔偺惗柦妶摦偼丆壏搙偲枾愙側娭學傪帩偭偰偄傞丏偦傟
偼丆惗柦妶摦偑惗懱撪偱偺庬乆偺壔妛斀墳偵婎偯偄偰偍傝丆偦偺斀墳懍搙偑壏搙偵嫮
偔埶懚偟偰偄傞偐傜偱偁傞丏壏擬惗棟妛偺暘栰偱偼丆俻10抣偲偄偆巜昗傪梡偄傞偙偲
偑偁傞丏偙傟偼丆偁傞壔妛斀墳偺偁傞壏搙倲偱偺懍搙k(t)偑丆壏搙偑10亷忋徃偟偨応
崌偵壗攞偵側傞偐傪昞傢偡傕偺偱偁傞丏偡側傢偪丆
丂丂丂丂丂丂俻10亖k(t+10)/k(t)
僸僩偺恎懱撪偱偺僄僱儖僊乕戙幱偵偮偄偰偼丆俻10抣偼2.3乣2.5偱偁傞偲尵傢傟偰偄
傞丏偟偨偑偭偰丆傕偟偙偺抣偑峀偄壏搙斖埻偵傢偨偭偰堦掕偱偁傞偲壖掕偱偒傟偽丆
僸僩偺懱壏偑10亷壓偑偭偨偲偒偺僄僱儖僊乕戙幱偺懍搙偼丆惓忢懱壏帪偺40乣43
亾丆20亷壓偑偭偨偲偒偵偼16乣19%偵掅壓偡傞偙偲偵側傞丏偙偺悢帤偺惓妋搙偼偲傕
偐偔偲偟偰丆懱壏偺掅壓偵敽偄戙幱妶摦偑撦偭偰偄偔偙偲偼丆嫲傜偔偡傋偰偺惗暔偵
嫟捠偺偙偲偲峫偊傜傟傞丏
丂忋偵弎傋偨傛偆側帠幚偵偮偄偰偼丆崱偐傜300擭埲忋傕慜偺1683擭偵Robert
Boyle(1627乣1691)偑榑暥傪彂偄偰偍傝丆偦偺拞偱嫑傗奮傪抁帪娫晹暘搥寢偟偨屻
慼惗偝偣傞偲偄偆幚尡偺寢壥偑曬崘偝傟偰偄傞乮Rubinsky[2]偵傛傞乯丏
丂尰嵼丆掅懱壏偺棙梡偼懡偔偺堛椕暘栰偱峴傢傟偰偄傞偑丆偦偺尨棟揑崻嫆偼忋偵弎
傋偨傛偆側偲偙傠偵偁傞丏1930擭偵報嶞偝傟偨丆僔僇僑戝妛搶梞暥壔尋媶強敪峴偺暥
專偵傛傟偽丆掅懱壏堛椕偵偮偄偰偺嵟傕屆偄婰榐偼丆婭尦慜2500擭崰偺傕偺偲偝傟傞
僄僕僾僩偺僷僺儖僗偵尒傜傟丆摢奫偺暋嶨崪愜傗壔擽偟偨奜彎偺帯椕偵椻幖晍偺巊梡
偑悇彠偝傟偰偄傞偦偆偱偁傞(Rubinsky[2]偵傛傞乯丏尰嵼偺掅懱壏庤弍偺懡偔偼丆懱
壏傪20亷慜屻偵壓偘偰峴傢傟偰偄傞偑丆栚揑偵傛偭偰偼0亷傑偱偺偝傜偵掅偄壏搙偑
棙梡偝傟傞偙偲傕偁傞(Chato[3], 垻慮丒嬿揷[4]乯丏
丂偟偐偟丆惗懱慻怐偺壏搙傪0亷埲壓偵壓偘傞偲丆嵶朎撪偺悈偑搥寢偡傞壜擻惈偑弌偰
偔傞丏嵶朎撪偵偱偒偨昘偼嵶朎枌傪攋夡偡傞丏偙傟傪庤弍偵棙梡偡傞偺偑搥寢庤弍
乮cryo-surgery)偱偁傝丆昘徎惗惉偵傛傞忈奞傪嬌椡梷偊側偑傜惗懱慻怐傪挻掅壏忬
懺偱曐懚偡傞媄弍偑搥寢曐懚乮cryopreservation)偱偁傞丏偟偨偑偭偰丆偙傟傜擇偮
偺媄弍偼丆掅壏偵偍偄偰婲傞憡曄壔尰徾傪丆堦曽偼攋夡偵棙梡偟丆懠曽偼惗柦曐帩偵
棙梡偡傞偲偄偆揰偱昞棤堦懱偺傕偺偱偁傞丏傑偨杮峞偱偼怗傟側偄偑丄怘昳側偳偺搥
寢姡憞偲傕枾愙側娭楢偑偁傞丏側偍丆cryo-偲偄偆愙摢岅偼乮挻乯掅壏傪堄枴偡傞偵傕
偐偐傢傜偢丆朚栿偱偼搥寢偲偄偆尵梩偵抲偒姺偊傜傟偰偄傞丏偙傟偼晄惓妋側栿岅偱
偁傞偑丆偡偱偵偐側傝掕拝偟偰偍傝丆崱偝傜曄偊傞偺偼崲擄偱偁傠偆丏
俁亅侾丏搥寢庤弍
丂塸崙偺撪壢堛偺James Arnott偑1845擭偵敪昞偟偨丆娻帯椕偺偨傔偺搥寢攋夡偺棙
梡偵娭偡傞曬崘偑丆搥寢庤弍偵偮偄偰偺榑暥偲偟偰嵟弶偺傕偺偱偁傞乮Rubinsky
[2]).丂
丂Arnott偼丆僽儔僀儞梟塼傪姵晹偺旂晢慻怐偵拲偄偱搥寢偝偣偨丏偦偺屻丆塼懱嬻婥
偑惢憿偝傟丆傑偨挋憼媄弍傕恑曕偟偨寢壥丆1930擭偐傜1940擭偵偐偗偰搥寢庤弍偼
媫懍偵晛媦偟偨丏偟偐偟丆1940擭傪夁偓傞偲搥寢庤弍偺尋媶偼媫偵掆懾偡傞丏
丂1960擭戙偵側偭偰丆暷崙偺奜壢堛Irving Cooper偲摨椈偺A. S. Lee偑搥寢庤弍梡
偺怴偟偄摴嬶傪奐敪偟偰偙偺暘栰偵暅妶偺偒偭偐偗傪傕偨傜偟偨丏Cooper傜偺摴嬶
偼丆愭抂晹傪彍偄偰恀嬻抐擬偝傟偨嬥懏娗偵塼懱拏慺傪弞娐偝偣傞曽幃偺傕偺偱丆斵
摍偼偙傟傪梡偄偰僷乕僉儞僜儞巵徢偺尨場偲側偭偰偄偨擼撪慻怐偺搥寢攋夡偵惉岟偟
偨丏
丂Rubinsky[2]偵傛傟偽丆搥寢庤弍偺晛媦偺偨傔偵偼丆(a)搥寢椞堟偺戝偒偝傪庤弍拞
偵妋幚偵儌僯僞乕偟丆(b)偳傟偩偗偑幚嵺偵攋夡偝傟偨偐傪抦傞昁梫偑偁傞丏Cooper
傜偺応崌偵偼丆姵幰偺恔偊乮僷乕僉儞僜儞巵徢偺徢忬偺堦偮乯傪儌僯僞乕偡傞偙偲偵
傛偭偰丆娫愙揑側偑傜庤弍偺惉斲偺栚埨偲偟偨丏尰嵼偱偼丆偙偺傛偆側儌僯僞儕儞僌
偼丆挻壒攇夋憸傗俵俼俬側偳偺僴僀僥僋媄弍偺棙梡偲丆惗懱慻怐撪偱偺搥寢夁掱偺惗
懱揱擬岺妛揑悢抣僔儈儏儗乕僔儑儞偺暪梡偵傛偭偰丆偼傞偐偵恑傫偩宍偱峴傢傟傞傛
偆偵側偭偰偄傞丅
丂側偍搥寢庤弍偼丆嬤擭擔杮偵偍偄偰傕懡偔偺昦堾偱幚巤偝傟傞傛偆偵側傝偮偮偁
傝丆娻側偳偺帯椕偵岠壥傪嫇偘偰偄傞丏摿偵丆撪帇嬀偲搥寢巕乮塼懱拏慺側偳傪棳偡
搥寢梡偺儊僗乯傪慻崌偣偨庤弍嬶偑埿椡傪敪婗偟偰偄傞丏偙偺庤弍嬶偼尦乆暷崙偱惢
嶌偝傟偨傕偺偱偁傞偑丆嵟嬤偱偼椻搥婡儊乕僇乕側偳偵傛傞媄弍奐敪偑媫懍偵恑傫偱
偄傞傛偆偱偁傞乮憼杮[5])丏
俁亅俀丏搥寢曐懚
慜弎偺傛偆偵丆惗懱撪偱偺僄僱儖僊乕戙幱偵偐偐傢傞壔妛斀墳偺懍搙偼壏搙偲偲傕偵
掅壓偡傞偐傜丆惗懱傪椺偊偽 -100亷埲壓偲偄偆掅壏壓偵抲偔偙偲偑偱偒傟偽丆尨棟
揑偵偼挿婜娫偺曐懚偑壜擻偱偁傞丏偨偩偟偙偺帪丆惗懱嵶朎偑椻媝偵敽偆暔棟壔妛揑
偁傞偄偼惗棟妛揑曄壔偵傛傝丆夞暅晄擻側忈奞傪旐傜側偄偙偲偑昁梫忦審偱偁傞丏
丂徻偟偄愢柧偼徣棯偡傞偲偟偰丆惗懱慻怐傪昘揰壓傑偱乮偦偟偰偝傜偵挻掅壏傑偱乯
椻媝偡傞嵺偵婲傝偆傞忈奞乮偙傟傪搥奞偲偄偆乯偵偼丆戝偒偔暘偗偰擇庬椶偑偁傞丏
堦偮偼丆嵶朎慻怐撪偵敪惗偡傞昘徎偵傛傞婡夿揑懝彎偱偁傝丆傕偆堦偮偼揹夝幙梟塼
偑擹弅偝傟偨寢壥惗偢傞抈敀幙偺曄惉偵傛傞懝彎乮墫奞乯偱偁傞丏
丂偙偺傛偆側搥奞傪夞旔偡傞偨傔偵偼丆懳徾偲側傞惗懱慻怐傪乮侾乯媫懍偵椻媝偟
偰丆嵶朎偺撪奜偵昘徎傪傑偭偨偔嶌傜偣偢偵屌壔偡傞丆偡側傢偪僈儔僗壔
乮vitrification乯偡傞曽朄偲丆乮俀乯揔愗側椻媝懍搙傪慖傫偱娚懍椻媝偟丆偨偲偊昘
徎偑惗惉偟偨偲偟偰傕丆偦傟偵傛傞忈奞偑抳柦揑側傕偺偵側傜側偄傛偆偵偡傞曽朄偺
擇偮偑偁傞丏
丂尨棟揑偵偼摉慠乮侾乯偺曽朄偑桪傟偰偄傞丏嵶朎偺撪奜偵偁傞塼憡偑偦偺傑傑偺宍
偱屌壔偡傞偐傜偱偁傞丏偙偺曽朄傪嵟弶偵帋傒偰惉岟偟偨偺偼丆塸崙偺Basil Luyet偱
1937
擭偺偙偲偱偁偭偨丏Luyet偼丆嵶朎偺搥寢曐懚傪惉岟偝偣傞偵偼丆搥寢偵傛偭偰嵶朎撪
偺峔惉梫慺偺攝楍傪偄偝偝偐偱傕曄偊偰偼側傜側偄偲峫偊丆偦傟偵偼僈儔僗壔偑桞堦
偺曽朄偩偲偄偆寢榑偵払偟偨丏
丂偙偺傛偆側Luyet偺敪憐偼妋偐偵惓偟偄偑丆尰幚傊偺揔梡偵偼崲擄偑偁傞丏懡偔偺塼
懱偵偮偄偰丆偦偺僈儔僗壔傪幚尰偡傞偵偼丆偒傢傔偰戝偒側椻媝懍搙偑昁梫偩偐傜偱
偁傞丏偙偺偙偲偲娭楢偑偁傞偲巚偆偑丆Luyet傜偑峴偭偨搥寢曐懚幚尡偱偼丆幚嵺偵偼
僈儔僗壔偑婲偭偰偄側偐偭偨偙偲偑丆屻偵壗恖偐偺尋媶幰払偵傛偭偰妋擣偝傟丆傑偨
Luyet帺恎傕帺傜偺尋媶偵懳偟偰斲掕揑側尒夝傪昞柧偟偰丆1960擭戙偺屻敿偵尋媶傪
拞巭偟偰偟傑偭偨丏
丂堦曽丆娚懍椻媝偵傛傞搥寢曐懚媄弍傪捛媮偟偰偄偨尋媶幰払偺拞偱丆塸崙偺Ernest
J. Christopher Polge偲Audrey Smith 偼丆塸崙崙棫堛妛尋媶強偵嵼愋偟偰偄偨
1940擭戙偺偁傞擔丆媿偺惛塼偺搥寢曐懚幚尡拞偵丆偦傟傑偱壛偊偰偄偨摐塼偺戙傝偵
岆偭偰僌儕僙儕儞傪壛偊偨帋椏偱幚尡偟偨偲偙傠丆曐懚忬懺偑偼傞偐偵椙偔側傞偙偲
傪敪尒偟偨丏偙傟偑搥奞杊屼嵻乮cryoprotective agent, CPA乯偑巊傢傟弌偡偒偭偐
偗偲側傞戝敪尒偱偁偭偨丏偙傟傪婎偵偟偰丆Polge傜偼娚懍椻媝偲搥奞杊屼嵻巊梡偵傛
傞搥寢曐懚媄弍偺恑揥偵懡戝偺峷專傪偟偨乮偙傟傜偺岟愌偵懳偟丆Polge攷巑偵偼
1992擭偵擔杮崙嵺徿偑憽傜傟偨乯丏
丂側偍丆弶傔偼嵶朎慻怐偺娚懍椻媝偵偍偗傞搥奞梷巭偵栶棫偮偲峫偊傜傟偰偄偨搥奞
杊屼嵻偼丆偦偺屻僈儔僗壔偵傛傞搥寢曐懚偵傕桳岠偱偁傞偙偲偑傢偐偭偰偒偨丏偦傟
偼丆僌儕僙儕儞側偳偺搥奞杊屼嵻傪崅擹搙偱梡偄傞偲丆僈儔僗揮堏壏搙偑忋徃偟丆偁
傞擹搙埲忋偱偼昘徎敪惗偺偨傔偺嬒幙妀惗惉壏搙傪挻偊傞偐傜偱偁傞偲愢柧偝傟偰偄
傞乮椺偊偽Fahy[6]乯丏幚嵺丆尰嵼偱偼丆愒寣媴偦偺懠偺寣塼惉暘丆崪悜嵶朎丆惛塼丆
庴惛棏側偳偺搥寢曐懚偼丆傎偲傫偳偑崅擹搙搥奞杊屼嵻傪梡偄偨僈儔僗壔朄偵傛偭偰
偄傞丏
丂偟偐偟丆扨堦嵶朎偁傞偄偼彫悺朄偺扨弮慻怐偵偼偁傞掱搙桳岠側偙偺曽朄傕丆憻婍
側偳偺傛偆側戝宆偱暋嶨側峔憿傪帩偭偨惗懱慻怐偺搥寢曐懚偵偮偄偰偼丆傑偩栤戣傪
書偊偰偄傞丏搥奞杊屼嵻偺慻怐撪傊偺堦條側媧廂丆慻怐慡懱偺嬒堦側椻媝丆崅擹搙搥
奞杊屼嵻偵傛傞旐撆側偳偺栤戣偼傎偲傫偳枹夝寛偺傑傑偱偁傞丏
係丏偍傢傝偵
丂掅壏惗暔岺妛偼丆忢壏埲壓愨懳楇搙傑偱偺壏搙堟偵偍偗傞惗懱偺彅尰徾偺壢妛揑側
夝柧偲丆偦偺墳梡媄弍傊偺揥奐傪栚揑偲偡傞妛栤偱偁傞丏岺妛偺傎偲傫偳偡傋偰偺暘
栰偲丆堛妛丒擾妛傪娷傓峀媊偺惗暔妛偲偺嫬奅椞堟偱偁傝丆懳徾偲側傝偆傞尋媶奐敪
偺壽戣偼偒傢傔偰懡婒偵傢偨傞偑丆杮峞偱偼庡偲偟偰堛岺妛偵娭楢偡傞榖戣偵尷掕偟
偰弎傋偨丏
丂Hippocrates埲棃丆擇愮悢昐擭偵媦傇堛妛偺楌巎偺拞偱丆掅壏堛妛偺楌巎偼傑偩擔
偑愺偄丏杮暥拞偱偼丆擔杮偵偍偗傞偙偺椞堟偺敪揥偺宱夁偵偮偄偰偼傎偲傫偳怗傟側
偐偭偨偑丆偙傟偵偮偄偰偼嬿揷[7][8]偵傛傞夝愢側偳傪偍撉傒偄偨偩偒偨偄丏暥專[7]
偵傛傟偽丆擔杮偱偼掅壏堛妛夛偑1974擭偵敪懌偟丆埲棃枅擭妛夛偑奐偐傟偰偄傞丏昅
幰偺娭學偟偰偄傞偲偙傠偱偼丆堦嶐擭(1995擭)偦傟傑偱偺乽搥寢媦傃姡憞尋媶夛乿偑
乽掅壏惗暔岺妛夛乿偲屇徧傪曄偊偰偄傞丏偙偺妛夛偵偼丆岺妛丒堛妛丒擾妛丒悈嶻
妛丒掅壏惗暔妛側偳懡條側暘栰偺尋媶幰丒媄弍幰偑嶲壛偟丆枅擭侾夞僔儞億僕僂儉偑
奐偐傟偰偄傞丏
丂尰嵼丆掅壏惗暔岺妛偼偄傠偄傠側曽柺偐傜拲栚傪梺傃偰偄傞偑丆惗暔偲偄偆挻暋嶨
宯傪懳徾偲偟丆偦偺峔憿偺婎杮偑嵶朎偲偄偆儈僋儘梫慺偵偁傝丆偟偐傕惗柦妶摦偲偄
偆恖娫偵偲偭偰嵟傕杮幙揑偱偁傝側偑傜嵟傕棟夝偟擄偄尰徾傪庢傝埖偆偲偙傠偐傜丆
懡偔偺枹夝寛偺壽戣偑庤晅偐偢偺傑傑嶳愊偟偰偄傞丏嫲傜偔丆偙偺暘栰偺敪揥傪乽楌
巎乿偲偄偆娤揰偐傜傑偲傑偭偨宍偱婰弎偡傞偵偼丆傕偆敿悽婭偼昁梫偱偁傠偆丏偙偺
偙偲傪尵偄栿偲偟偰丆偙偺嶨暥傪廔偊傞偙偲偵偟偨偄丏
俆丏堷梡暥專
[1] Benzinger, T.H.(ed.), "Temperature, Part 1 (Art and Concept)," Dowden,
Hutchinson & Ross, Inc. (1977), p.31.
[2] Rubinsky, B., "Recent Advances in Cryopreservation of Biological
Organs and in Cryosurgery," Proc. 8th Int. Heat Transfer Conf., San
Francisco, Vol.1 , (1986), pp.307乣316.
[3] Chato, J.C., "Heat Transfer in Bioengineering," in Advanced Heat
Transfer, (Chao, B.T., ed.), University of Illinois Press (1969),
pp.395乣414.
[4] 垻慭峅堦,丂嬿揷岾抝乮曇乯,乽掅壏堛妛乿丆挬憅彂揦 (1983), pp.421乣451.
[5] 憼杮怴懢榊, 乽搥寢庤弍偺崱擔偺僩僺僢僋僗乿, 椻搥, 68-787 (1993),
pp.482乣488.
[6] Fahy, G.M., "Vitrification," in Low Temperature Biotechnology
(McGrath, J.J. and Diller, K.R., ed.), ASME BED-Vol.10/HTD-98 (1988),
pp.113乣146.
[7] 嬿揷岾抝, 乽堛椕偵偍偗傞掅壏偺棙梡乿, 椻搥, 64-745 (1989),
pp.1225乣1250.
[8] 嬿揷岾抝, 乽寣塼丒憻婍丒惛塼挋憼乿, 椻搥, 71-819 (1996), pp.50乣58.
All Rights Reserved, Copyright (C) 1997, The Japan Society of Mechanical Engineers.
Bioengineering Division